●陳秀熙/台灣大學公共衛生學院預防醫學與流行病學研究所教授
●張金堅/台灣大學外科教授
●許辰陽/台灣大學公共衛生學院公共衛生碩士學位學程兼任助理教授
●陳立昇/台北醫學大學口腔醫學院副院長
國產疫苗第二期臨床試驗解盲後
近日國產疫苗的解盲希望與契機,透過媒體以公開的方式,報導本次重要的臨床第二期試驗初步解盲結果,台灣民眾得以接收第一手的臨床試驗科學訊息。
而疫苗研發過程中投注大量心血的政府單位、生物科技產業,研究單位,以及參與臨床試驗的醫療單位,能透過解盲過程向大眾報導疫苗的研究設計、執行過程,以及研究結果,對於台灣國產疫苗未來在疫苗產業鏈,自主發展及供應產生一線曙光。
面對目前全球新冠肺炎疫情嚴峻下,如何免疫橋接第二期至第三期臨床試驗,以克服快速變種病毒變異,成為全球疫苗開發重要議題,加上日後國產疫苗欲能達到國際品質及認可,以協助全世界供應疫苗給第三世界國家,來及時控制疫情大流行。
為了更能夠了解二期免疫橋接三期對疫情控制之意義及精神,本文以過去三期臨床試驗mRNA,載體及重組蛋白Novavax第一代疫苗為例,說明該疫苗第二期與第三期臨床試驗之不同,並以這些疫苗驗證這第一代疫苗二期免疫橋接三期之科學實證,再論及疫苗為何要有第三期臨床試驗,才可達到符合國際認同的條件。
▲國產疫苗遭質疑未經「三期臨床試驗」。(圖/記者蔡玟君攝)
WHO新冠肺炎疫苗開發二期橋接三期議題
世界衛生組織(WHO)於5月26日邀集世界各國的疫苗研發與管理專家,以及疫苗開發生產企業召開新冠肺炎疫苗保護效益評估會議。
會中以二期免疫原性橋接三期疫苗臨床保護相關因子(Correlate of Protection,CoP)為主題,期望藉由各國專家以及產業界的討論,建立加速疫苗生產的共識。
標準的疫苗開發需由第二期臨床試驗以實驗室方法,驗證施打疫苗可以產生的中和抗體效價濃度後,進行第三期臨床試驗評估施打疫苗於人體,是否可降低感染症狀個案與重症的臨床效益。
為了在當前病毒快速變異的情境下控制全球疫情,WHO召開此會議目標在尋求以第二期臨床試驗的實驗室結果,預測第三期臨床試驗的人體施打保護力效益,或稱為二期免疫橋接三期疫苗臨床試驗評估。但會中各國對於此一評估方式仍有許多不同意見,其中以歐盟以及韓國外多數國家仍存有許多疑慮。

▲二期免疫橋接三期疫苗臨床試驗評估,是否可行爭論不斷。(示意圖/翻攝國藥集團)
二期疫苗免疫反應橋接三期臨床試驗
面對新冠肺炎病毒(SARS-CoV-2)不斷發生變異株,各國提出第二代疫苗以及疫苗施打時,是否可以混合不同廠牌與種類等問題,若採用第三期臨床試驗進行評估則須追蹤新冠肺炎感染,得病以及重症等臨床事件終點才能提供科學實證(del Rio and Malani, 2021)。
為了更有效率的開發新疫苗並且兼顧疫苗效益的科學實證,運用第二期臨床試驗激發的人體保護性免疫反應結果來對於可能達到的臨床保護力進行推測,以提供大規模使用緊急授權的科學佐證,就是所謂二期免疫橋接三期臨床試驗(Jin et al., 2021; Krammer 2021; WHO, 2013)。
▲接種疫苗。(圖/路透)
目前對於新冠肺炎疫苗的保護性免疫反應主要著重於中和抗體濃度之評估,藉由在第二期臨床試驗中比較疫苗引發的中和抗體濃度,與康復者血清可達到的抑制病毒侵襲濃度比較,預測疫苗可達到的臨床保護力,就是前述所稱二期免疫橋接三期臨床保護力(Correlate of Protection ,CoP)。
就目前完成第三期臨床試驗的疫苗數據顯示,個別疫苗第二期臨床試驗疫苗組,與康復者血清相較的中和抗體效價倍數,或可做為推測疫苗在第三期臨床試驗可達到效益之依據(Khoury et al., 2021)。
圖一為此二期橋接三期床試驗的設計與思維。在第二期臨床試驗的結果量測,研究可得到疫苗接種受試者、康復者血清,以及安慰劑組的中和抗體濃度。在實際應用中,此疫苗中和抗體血清濃度與康復者血清之反應倍數,或可做為預測第三期臨床試驗中可觀察到的臨床保護力(預測保護力,O圈),提供CoP證據。
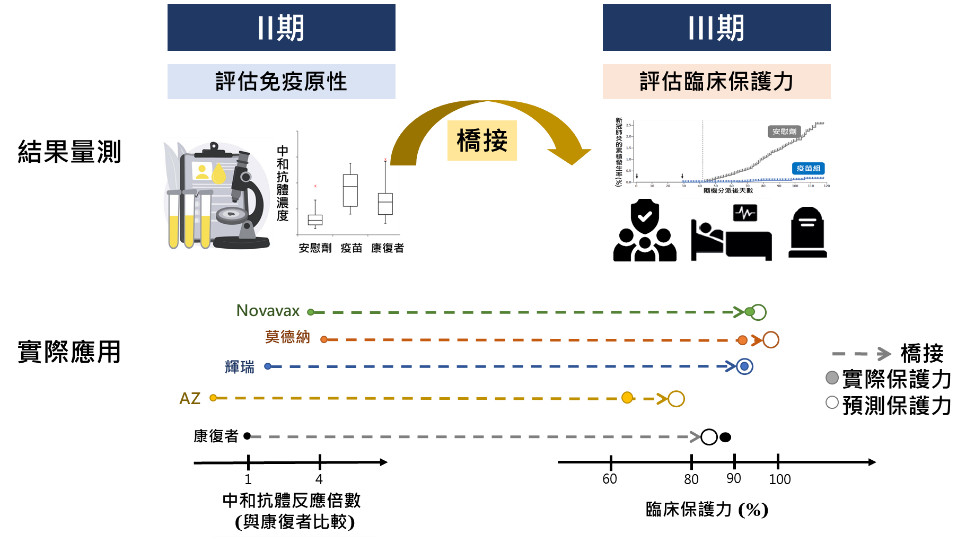
▲圖一、 二期免疫橋接三期臨床試驗。(圖/撰稿團隊提供)
此一預測保護力與實際進行第三期臨床試驗所觀察到的保護力(實際保護力,實心圈)若相當接近,在發展新疫苗時,即可成為二期免疫橋接三期的評估替代終點。
圖一列出第一代疫苗CoP之證據,若以重組蛋白Novavax疫苗為例,第二期臨床試驗之中和抗體血清效價(3906)為康復者血清(983)的3.97倍,所預測的臨床保護力接近90%,與該疫苗第三期臨床試驗報導的施打效益達89%相去不遠(Keech et al., 2020; del Rio and Malani, 2021; Khoury et al., 2021)。
mRNA疫苗莫德納(mRNA-1273)與輝瑞(BNT162b2)在第二期臨床試驗之的中和抗體濃度,皆超過康復者血清4倍,預期保護力皆超過90%,也與第三期臨床試驗的效益接近(Khoury et al., 2021)。
▲輝瑞疫苗。(圖/路透)
在此一科學證據下,疫苗組相較於康復者血清的中和抗體效價,可做為評估臨床保護力的替代評估指標。以目前所解盲國產疫苗其中和抗體之效價反應,若能與康復者血清中和抗體效價比較,則可提供預測臨床保護力CoP證據。
上述第一代疫苗橋接科學驗證是否能應用於第二代疫苗,以二期免疫橋接三期臨床試驗,在科學界仍有諸多正反意見的討論,需待國際間達成共識 (WHO, 2021),其爭議點仍然在於二期及三期臨床試驗在臨床保護力有效性之差別。
為能夠了解此差別,以Novavax 疫苗為例,說明疫苗第二期臨床試驗以及第三期臨床試驗試計,及評估有效性目標之差異。
▲Novavax疫苗。(圖/路透)
Novavax疫苗第一/二期臨床試驗
美國Novavax疫苗為重組SARS-CoV-2奈米顆粒疫苗,以全長三聚體SARS-CoV-2刺突蛋白及Matrix-M1佐劑組成。在第一/二期臨床試驗中,即利用隨機分派比較不同劑量,及是否使用佐劑之免疫原性及安全性差異(Keech et al., 2020)。
該疫苗第一/二期臨床試驗於2020年5月26日開始進行並招募262名自願者,經篩選131名合適者後進行隨機分派為五組,除了安慰劑組外,疫苗組則搭配劑量高低與有無佐劑等不同四組。
研究設計如圖二。第一/二期研究結果於同年9月2日發表,證實添加佐劑之疫苗組高低劑量可明顯產生免疫抗原反應,施打第一劑後,免疫抗原反應與無症狀新冠肺炎康復者血清抗體相近,施打第二劑後,免疫抗原反應甚至高出新冠肺炎門診患者,並與住院患者相近。
然而佐劑加入後,使用高劑量(25μg)及低劑量(5μg)之結果並無差異。疫苗組所引發可抑制99%病毒(Inhibitory concentration, IC)的中和抗體(Neutralizing antibody)效價濃度幾何平均數(Geometric mean,GMT,3906),與為康復血清數值(983)的3.97倍,疫苗造成的不良反應多數為輕度(Keech et al., 2020)。
在完成第二期臨床試驗後,Novavax疫苗於9月25日開始進行第三期臨床試驗,驗證施打疫苗的臨床效益。依據Novavax第二和第三期臨床試驗結果,施打兩劑Novavax疫苗可有效對抗新冠肺炎病毒的感染,效力高達89.3%,在老年人和愛滋感染者這些免疫力相對較差的族群同樣有效(Novavax, 2021; Rio and Malani, 2021)。
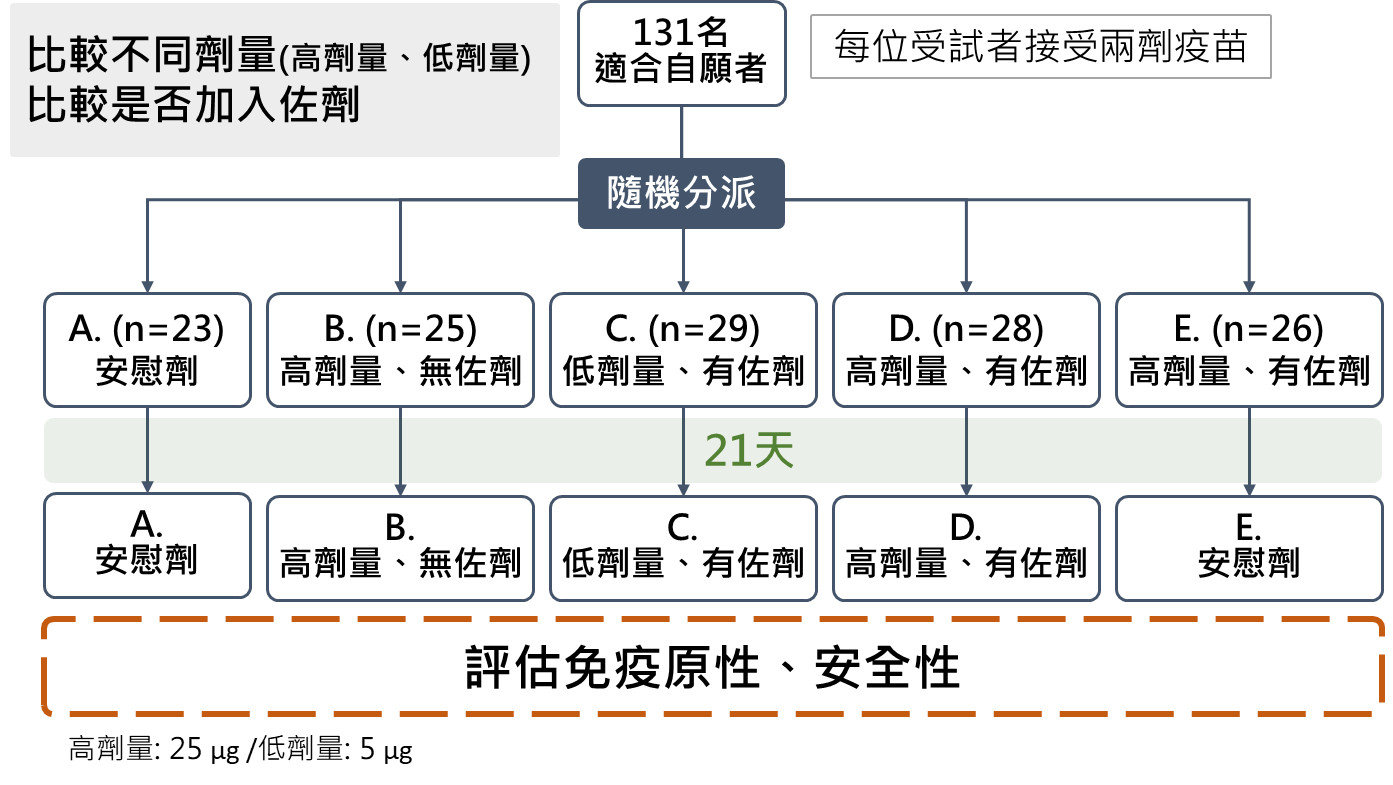
▲圖二: Novavax疫苗第一/二期臨床試驗研究設計。(圖/撰稿團隊提供)
由於疫苗第二期臨床試驗中的主要目的,為評估人體是否可以透過疫苗,激發具有保護力的免疫反應,以及檢視疫苗接種過程是否會對人體造成不良反應。為反應科學嚴謹度,利用隨機分派研究設計(randomized controlled trial design)加上盲測是第二期臨床試驗的重要特徵。
如圖二在此研究設計中,參與者以隨機的方式分派到疫苗組(接受疫苗施打)或安慰劑組(接受無效劑型如生理食鹽水施打),配合盲性(blinding)的執行方式,接受疫苗施打的參與者(單盲,single blind)、疫苗施打者(雙盲,double blind),以及評估分析者(三盲,triple blind),在研究分析進行時皆無法知道何人是接受疫苗或是無效劑。
隨機分派過程使得日後在檢視疫苗組與安慰劑組,所產生中和抗體與引發之不良反應時,可確保結果不受到如年齡、性別、病史等其他因子影響。
而盲性結合安慰劑組則可消除研究執行過程的公正,包含疫苗提供者與分析評估者在解盲(unblind)前提供給兩組的處理及對待一致性,而兩組的參與者在研究期間會影響結果健康行為,也不會因在不同組別而有所偏頗(Moher et al., 2010)造成偏差。
前述的Novavax疫苗第二期臨床試驗,即採用隨機分派研究設計配合雙盲進行評估。由於實際執行時的難度,疫苗組與安慰劑組通常採用1:1的方式進行。此外,第二期臨床試驗的主要目的,在評估是否可有效引發免疫反應,而非實際去檢視施打疫苗後,是否真的可以減少感染新冠肺炎。
因此,國際間的研究報導,皆會用參與試驗者在施打疫苗後的血清與康復者血清(Convalescent serum),比較疫苗引發的抗體效價,藉此推論疫苗的免疫原性(immunogenicity)。
▲疫苗試驗。(示意圖/路透)
Novavax第三期臨床試驗
Novavax疫苗在完成第二期臨床試驗後,即於美國與墨西哥共119個收案點展開第三期臨床試驗。該研究共納入29960位參與者,以2:1的比例將參與者隨機分派至疫苗組與對照組,並於6月14日估公佈期末報告。在三個月的觀察期間內,疫苗接種組發生14位新冠肺炎個案而對照組則有63位(圖三)。
疫苗接種組有14位新冠肺炎個案,皆為輕症。對照組中共有63位COVID-19個案,49位輕症,10位中度個案,以及4位重症個案。依據兩組之COVID-19臨床個案比較結果顯示,Novavax疫苗對於新冠肺炎的臨床保護力可達90.4% (95%信賴區間: 82.9-94.6%),對於中度及重症新冠肺炎臨床保護力則達100% (95%信賴區間: 87.0-100%)。
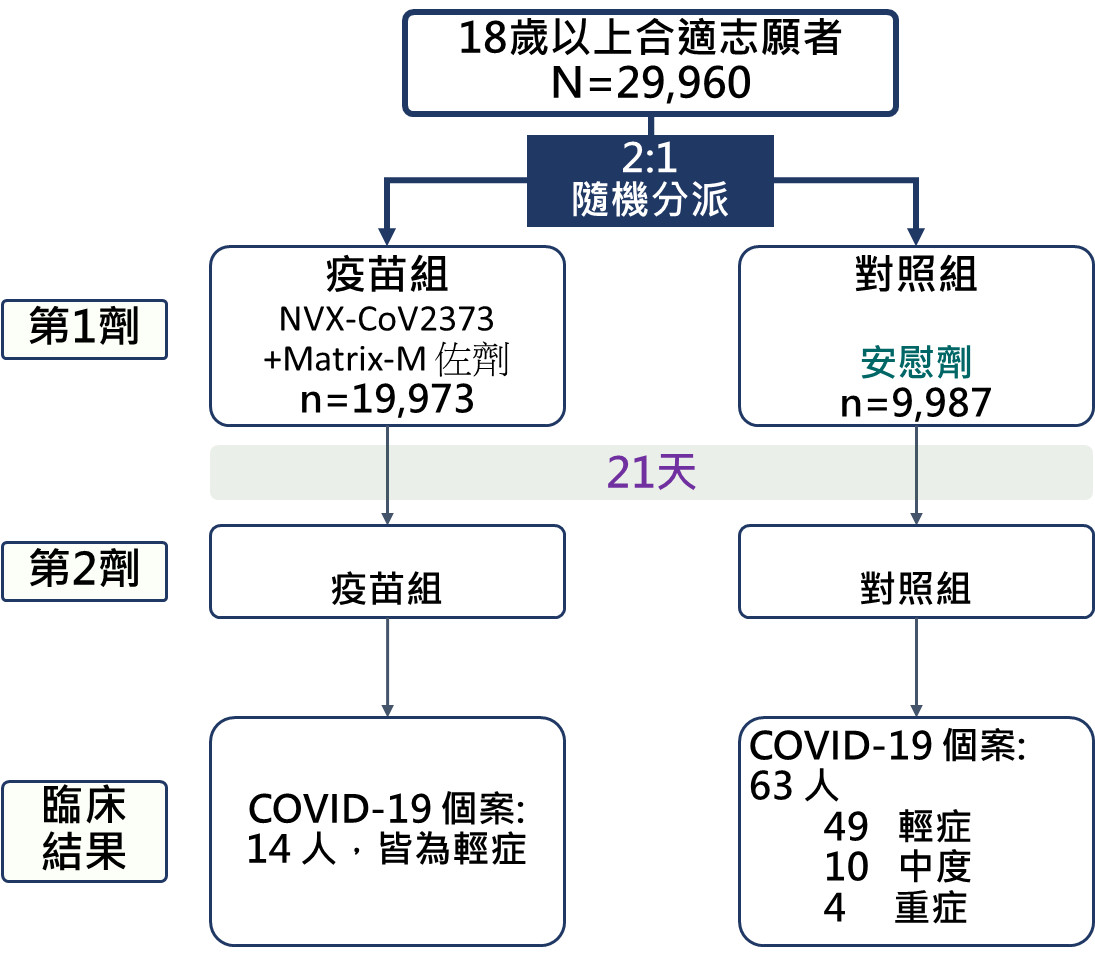
▲圖三、Novavax疫苗第三期臨床試驗研究設計。(圖/撰稿團隊提供)
臨床隨機分配試驗學術標準(CONSORT)
關於疫苗第二期與第三期臨床試驗的設計,與主要評估目標整理如表一。而對於臨床試驗的設計、執行、評估,與報導的呈現,國際上也有一致的共識與報告準則檢核表(Consolidated standards of reporting trials statement,CONSORT statement,Moher et al., 2010)。
為評估不同疫苗臨床試驗之品質,我們利用2013年規範臨床研究倡儀組織(Standard Protocol Items: Recommendations for Interventional Trials, SPIRIT) 提出的臨床試驗檢核表,搭配CONSORT statement進行檢核。例如,俄羅斯載體疫苗在二期臨床試驗是非隨機分派試驗,相較於隨機臨床試驗研究其臨床症據強度較低、不嚴謹,因此就不適合對此試驗做檢核評分。
英國牛津、嬌生載體疫苗,在檢核評分中分別為78分及82分,而輝瑞、莫德納的mRNA疫苗及Novavax所研發的重組蛋白疫苗,分別有高達82分、81分及81分的符合程度。試驗越能完整符合隨機分派之實驗設計,及相關配合措施如有無盲測、資料管理、及監控等,則表示臨床試驗的品質與結果越具可信度,也更能做為臨床使用授權審查的科學佐證。
表一也列出第三期臨床試驗與第二期臨床試驗,在安全性及有效性之不同,我們也可以同樣CONSORT標準,來評估這些第一代疫苗科學嚴謹性。
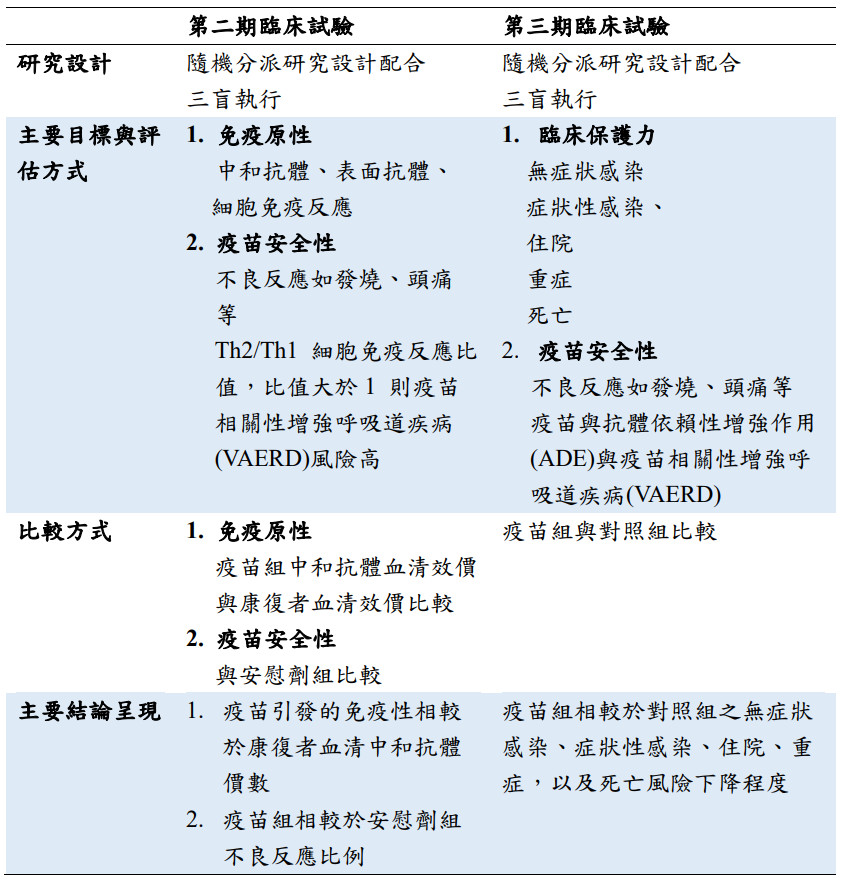
▲表一、第二期與第三期臨床試驗設計與評估要點。(圖/撰稿團隊提供)
疫苗廣泛使用前為何需要第三期臨床試驗?
在第二期臨床試驗完成疫苗免疫原性評估後,則須進入第三期臨床試驗,挑戰疫苗在實際接種於大規模族群時的臨床保護力。
雖然第二期臨床試驗可證實,疫苗能引起中和抗體等如同康復者一般的免疫反應,但疫苗是否可以達到保護接種者免於感染、產生症狀、住院、重症,或死亡的臨床保護力,則需要擴大納入參與者,並利用隨機分派與盲性設計的第三期臨床試驗,進行驗證與評估。
除了上述的Novavax疫苗,近期德國的mRNA疫苗CureVac其疫苗組中和抗體效價與康復者之數值相近(皆為113),倍數為1,低於其他兩個 mRNA疫苗而高於AZ載體疫苗。
但在納入約40000名參與者的第三期臨床試驗初步結果顯示,CureVac疫苗對於新冠肺炎的臨床保護力卻僅達47% (Dolgin, 2021)。此一結果顯示,若以二期免疫橋接三期臨床試驗的臨床保護力仍有其不確定性,仍需要第三期臨床試驗加以驗證。

▲德國curevac疫苗。(圖/翻攝自Facebook/curevac)
此外疫苗經驗一期及二期臨床試驗後,能否安全及有效的接種於族群,仍有以下一些問題仍須在第三期臨床試驗回答,包含疫苗是否安全以及如何評估疫苗安全性?除了疫苗接種後的不良反應,還需要評估疫苗與抗體依賴性增強作用(ADE)與疫苗相關性增強呼吸道疾病(VAERD)等安全性問題。
所謂ADE,是指當疫苗接種於人體後,產生了中和抗體,而當此中和抗體跟病毒結合,反而保護不了而讓病毒帶入人體的免疫系統中,造成人體不但無法消滅病毒,還使得病毒大量繁殖。
而VAERD則是因疫苗產生之抗體無法中和病毒,反而使大量病毒與抗體產生免疫複合物,激活補體產生過敏發炎反應而使呼吸道病情加重,如表一所呈列,這些嚴重安全性問題,必須在大規模第三期臨床試驗才有可能驗證。
▲三期疫苗臨床試驗相當重要。(示意圖/記者湯興漢攝)
疫苗臨床試驗緊急授權(EUA)與免疫橋接
由於疫情嚴峻,為了能夠及早施打疫苗降低疫情,對於二期橋接三新疫苗或改良二代疫苗,在每個國家皆必須經過緊急授權(EUA)。
為因應變種病毒發展的第二代疫苗,欲以二期免疫橋接三期臨床試驗而予以緊急使用授權,依以上論述建議應能證實,疫苗所產生的中和抗體相較康復者中和抗體濃度倍數,提供臨床保護力CoP預測的證據。更重要的是,必須檢視疫苗在面對不同變種病毒株下,其中和抗體表現上是否仍能維持和原病毒株相等的保護力。
表二列舉第一代疫苗在面對不同變種病毒時,其中和濃度表現相較於野生株或過去盛行的D614G病毒株的抗體濃度,均有不同程度的濃度下降情形,下降倍數越多代表該疫苗對抗該病毒的效益就會變得越差,表示必須進行疫苗改良品種。
同理可知,若第二代疫苗在二期對付某變種病毒的中和抗體,濃度表現一但有濃度下降的情形,而當該地區是盛行該變種病毒時,欲利用二期免疫橋接三期臨床試驗,在EUA上就必須非常小心。
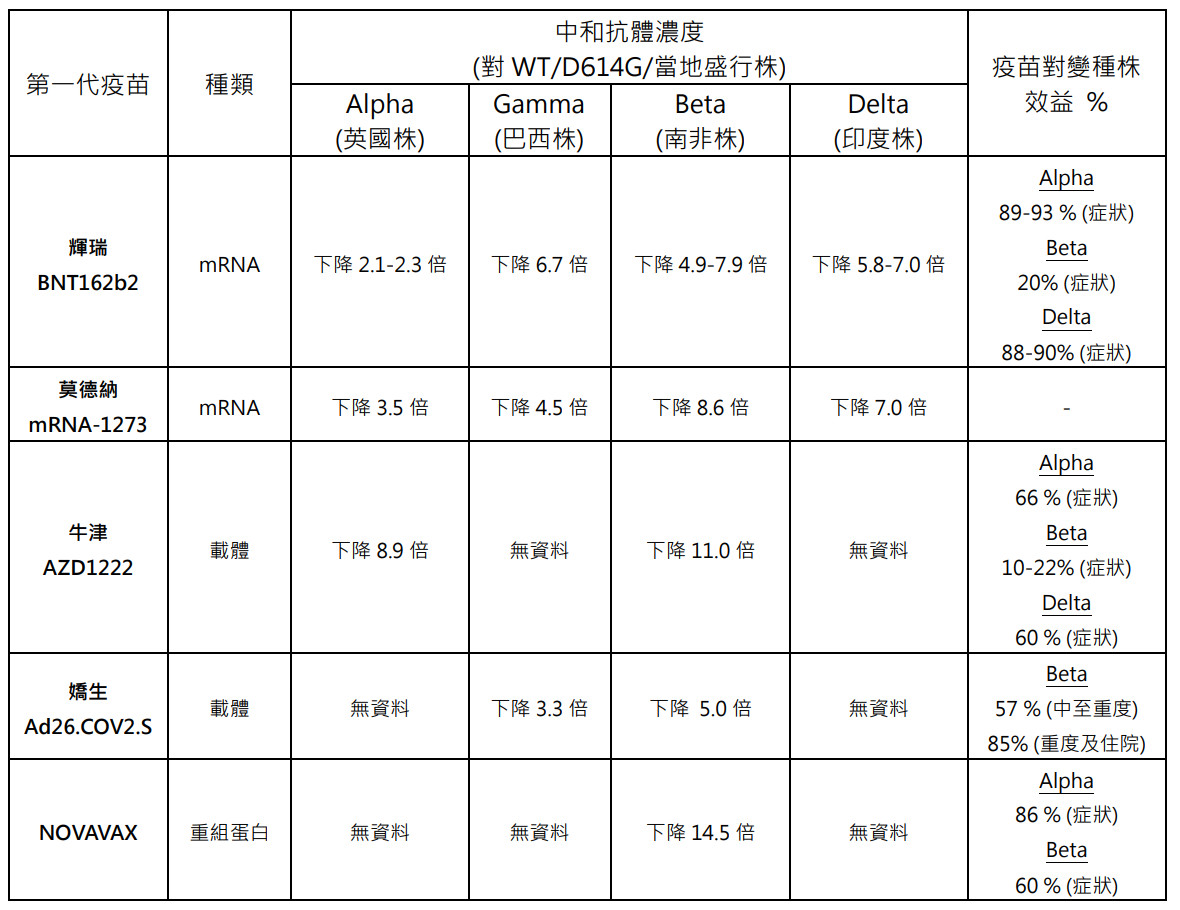
▲表二、變種病毒對疫苗效益影響。(圖/撰稿團隊提供)
結論
疫苗開發中的第二期臨床試驗,主要是評估疫苗接種過程,是否會對人體造成不良反應,以及可否激發免疫反應與保護力,然而疫苗是否可以避免感染或重症,產生臨床保護力,則需要擴大受試者,及利用第三期臨床隨機分派試驗進行評估。
然而,面對全球新冠肺炎變種病毒快速變異與嚴峻疫情,為能加速第二代疫苗開發以及時控制疫情,使用第二期臨床試驗激發的人體保護性免疫反應(中和抗體)結果,與康復者血清中和抗體比較,特別在不同變種病毒下的保護力,對可能達到的臨床保護力,進行推測以做為科學佐證,為提供緊急授權使用的權宜之計。
然而疫苗能否安全及有效的接種於族群,在國際間還未對二期免疫橋接三期臨床試驗有共識前,仍須依嚴謹的科學步驟及方法進行第三期臨床試驗,以符合實證科學的精神。
▲疫苗臨床試驗不可不慎。(示意圖/路透社)
參考資料
Dolgin E. CureVac COVID vaccine let-down spotlights mRNA design challenges. 2021 Nature. https://www.nature.com/articles/d41586-021-01661-0.
Jin, Pengfei, et al. "Immunological surrogate endpoints of COVID-2019 vaccines: the evidence we have versus the evidence we need." Signal Transduction and Targeted Therapy 6.1 (2021): 1-6.
Khoury, David S., et al. "Neutralizing antibody levels are highly predictive of immune protection from symptomatic SARS-CoV-2 infection." Nature medicine (2021): 1-7.
Keech, Cheryl, et al. "Phase 1–2 trial of a SARS-CoV-2 recombinant spike protein nanoparticle vaccine." New England Journal of Medicine 383.24 (2020): 2320-2332.
Knipe, David M., et al. "Ensuring vaccine safety." Science 370.6522 (2020): 1274-1275.
Krammer, Florian. "Correlates of protection from SARS-CoV-2 infection." The Lancet 397.10283 (2021): 1421-1423.
Moher, David et al. "CONONSORT 2010 Explanation and Elaboration: updated guidelines for reporting parallel group randomised trials." BMJ (2010); 340.
Novavax "COVID-19 vaccine demonstrates 89.3% efficacy in U.K. phase 3 trial." January 28, 2021. https://ir.novavax.com/news-releases/newsrelease-
details/novavax-covid-19-vaccinedemonstrates-893-efficacy-uk-phase-3
del Rio, Carlos, and Preeti Malani. "COVID-19 in 2021—Continuing Uncertainty." JAMA 325.14 (2021): 1389-1390.
World Health Organization (WHO). "Correlates of vaccine-induced protection: methods and implications." No. WHO/IVB/13.01., 2013.
World Health Organization (WHO) "COVID-19 vaccines: WHO meeting on correlates of protection" May 26, 2021. https://www.who.int/news-room/events/detail/2021/06/01/default-calendar/covid-19-vaccineswho-meeting-on-correlates-of-protection
熱門點閱》
► 少數族群面臨疫情威脅 疫調人員「文化能力」不可或缺(李柏翰)
●以上言論不代表本網立場,歡迎投書《雲論》讓優質好文被更多人看見,請寄editor88@ettoday.net或點此投稿,本網保有文字刪修權。






我們想讓你知道…疫苗能否安全及有效的接種於族群,在國際間還未對二期免疫橋接三期臨床試驗有共識前,仍須依嚴謹的科學步驟及方法進行第三期臨床試驗,以符合實證科學的精神。